उपसहसंयोजन यौगिको में समावयवता
दो या दो से अधिक रासायनिक यौगिक जिनके अणु सूत्र समान हो परन्तु उनकी संरचना या त्रिविम व्यवस्था भिन्न हो समावयवी कहलाते है एवं इस प्रक्रम को समावयवता कहते है।
ये यौगिक दो प्रकार की समावयवता प्रदर्शित करते है।
(i) संरचनात्मक समावयवता (Structural Isomerism)
(ii) त्रिविम समावयवता (Stereo Isomerism)
संरचनात्मक सावयवता
दो या दो से अधिक रासायनिक यौगिक जिनके अणु सूत्र समान हो परन्तु यौगिको की संरचना में भिन्नता हो तो ऐसे यौगिक संरचनात्मक समावयवी कहलाते है।
संरचनात्मक समावयवता को निम्न भागों में वर्गीकृत किया गया है-
आयनन सावयवता
– वे उपसहसंयोजक यौगिक जिनके अणु सूत्र समान हो परन्तु जलीय विलयन में पृथक-पृथक आयन देते हो आयनन समावयवी कहलाते है।
उदाहरण :- Co(NH3)5BrSO के दो आयनन समावयवी निम्न हैं-
[CO(NH3)5Br]SO4 (aq) → [Co(NH3) Br]2+ + SO42-
यह समावयवी BaCl2 के साथ सफेद रंग का BaSO4 का अवक्षेप देता है।
[CO(NH3)5SO4]Br(aq.) → [Co(NH3)5SO4]+ + Br
यह समावयवी AgNO, के साथ AgBr का हल्के पीले रंग का अवक्षेप देता है।
कुछ अन्य उदाहरण निम्न प्रकार है-
(i) [Pt(NH3)4Cl2]Br2 एवं [ Pt(NH3)Br2]Cl2
(ii) [Co(NO3)(NH3)5]SO4 एवं [Co(SO4)(NH3)5]NO3
(iii) [Co(en)2CI2]NO2 एवं [Co(en)2CINO2]CI2
हाइड्रेट समावयवता
– ऐसे उपहससंयोजक यौगिक जिनके अणु सूत्र समान हो परन्तु जल के अणुओं की संख्या समन्वयी मण्डल और आयनिक मंडल में भिन्न हो हाइड्रेट समावयवयी कहलाते है।
उदाहरण :- CrCl3.6H2O में तीन प्रकार के हाइड्रेट समावयवी पाए जाते है-
(i) [Cr(H2O)6]Cl3 बैंगनी रंग
(i) [Cr(H2O)5]CI2.H2O नीला हरा रंग
(iii) [Cr(H2O)4Cl2]CI.(H2O)2 गहरा हरा रंग
बंधक समावयवता
– ऐसे यौगिक जिनमें दंतुक लिगैंड, उभयदंतुक लिगैंड हो अर्थात् केन्द्रीय धातु परमाणु से लिगैंड के दो दाता परमाणु उपसहसंयोजक बंध से बंधित हो सकते हो बंधक समावयवी कहलाते हे।
उदाहरण :-
[Cr(H2O)5CN]CI2
पैंटाएक्वासायनोक्रोमियम (III) क्लोराइड
तथा
[Cr(H2O)5NC]Cl2
पैंटाएक्वाआयसोसायनोक्रोमियम (III) क्लोराइड
(ii) [Co(NH3)5NO2]Cl2
पैंटाएम्मीननाइट्रोकोबाल्ट (III) क्लोराइड
तथा
[Co(NH3)5ONO]Cl2
पैंटाएम्मीननाइट्राइटोकोबाल्ट (III) क्लोराइड
उपसहसंयोजन समावयवता
– इस प्रकार की समावयवता ऐसे उपसहसंयोजक यौगिको के द्वारा प्रदर्शित होती है जिनमें धनायन एवं ऋणायन दोनों संकुल आयन हो । संकुल धनायन एवं संकुल ऋणायन लिगैंडों का विनिमय कर लेते है।
उदाहरण :-
[Co(NH3)6] [CrCl6] तथा [Cr(NH3)6] [CoCl6]
(ii) [Pt(NH3)4] [PtCI4] तथा [PtCI(NH3)3] [PtCI3NH3]
लिगैंड समावयवता
– वे उपसहसंयोजक यौगिक जिनमें लिगैंड स्वयं समावयवता प्रदर्शित करते हो लिगैंड समावयवी कहलाते है।
उदाहरण :-
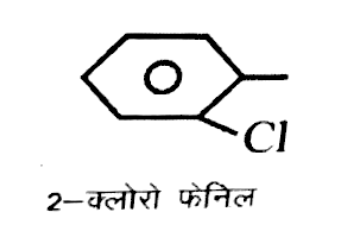
(i) [Cr(NH3)5{C6H4CI(2)}]CI3
(i) [Cr(NH3)5{C6H4CI(3)}]CI3
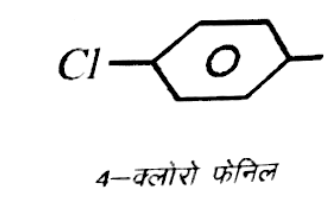
(ii) [Cr(NH3)5{C6H4CI(4)}]CI3
उपसहसंयोजन स्थिति समावयवता
– यह समावयवता सेतु लिगैंड युक्त उपसहसंयोजक यौगिक में पाई जाती है जहाँ अणु सूत्र समान होते है परन्तु संरचनात्मक सूत्रों में लिगैंड बंधन में भिन्नता पाई जाती है।
उदाहरण :-
त्रिविम समावयवता
उपसहसंयोजक यौगिक जिनके अणु सूत्र, संरचनात्मक सूत्र समान हो परन्तु केन्द्रीय धातु परमाणु से बंधित लिगैंडो की आकाशीय व्यवस्था भिन्न हो तो वे त्रिविन समावयवी कहलाते है एवं इस परिघटना को त्रिविम समावयवता कहते है ।
त्रिविम समावयावता को निम्न भागों में वर्गीकृत किया गया है –
ज्यामितीय समावयावता
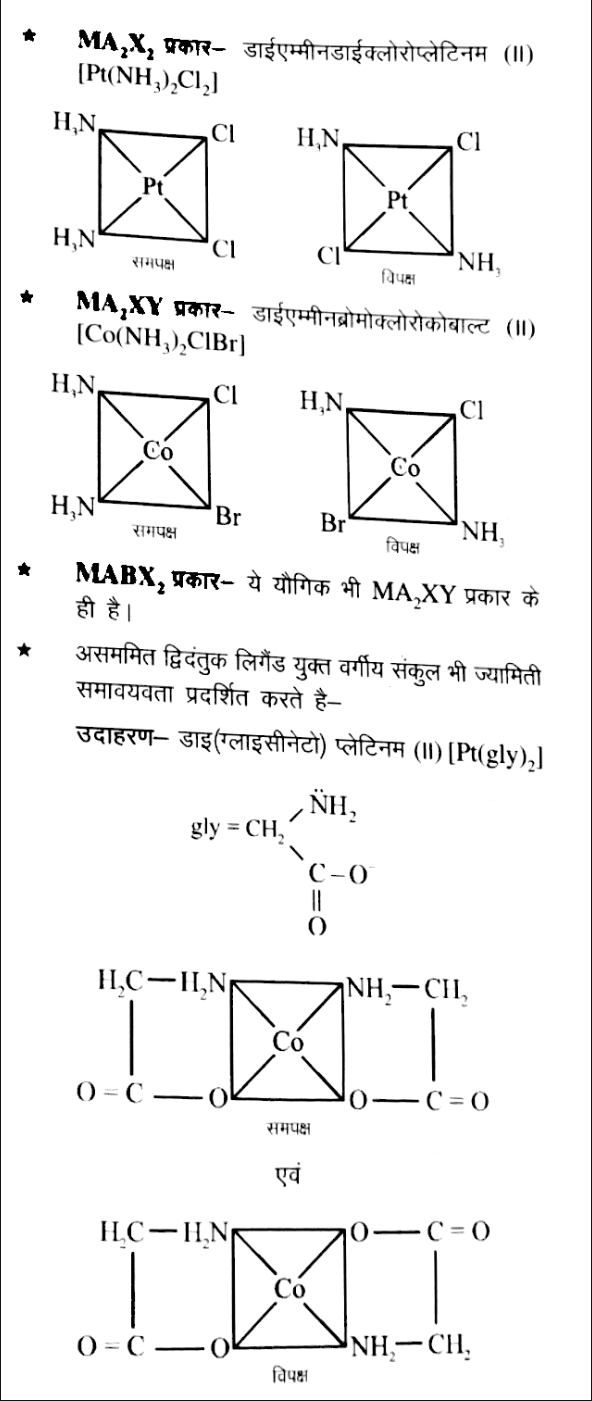
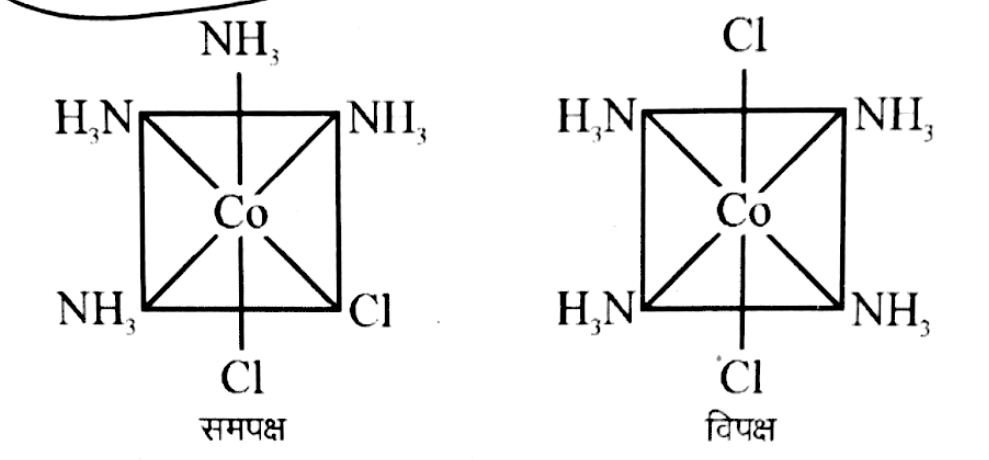
इस समावयावता को समपक्ष – विपक्ष समावयावता भी कहते है | केन्द्रीय धातु परमाणु के चारों और उपस्थित लिगैन्डों में से समान प्रकार के लिगैन्ड निकटवर्ती स्थिति पर हो तो यह समपक्ष समावयावी एवं विपरीत स्थिति में उपस्थित हो तो यह विपक्ष समावयावी कहलाते है |
ज्यामिती समावयावता समन्वयी संख्या 4 एवं समन्वयी संख्या 6 के संकुलों में पायी जाती है |
समन्वयी संख्या 4 के वर्ग समतलीय संकुल –
समन्वयी संख्या 6 के अष्टफलकीय संकुल में ज्यामिती समावयावता –
उदाहरण – टेट्राएम्मीन डाई क्लोरोकोबाल्ट (II)
[Co(NH3)4Cl2]
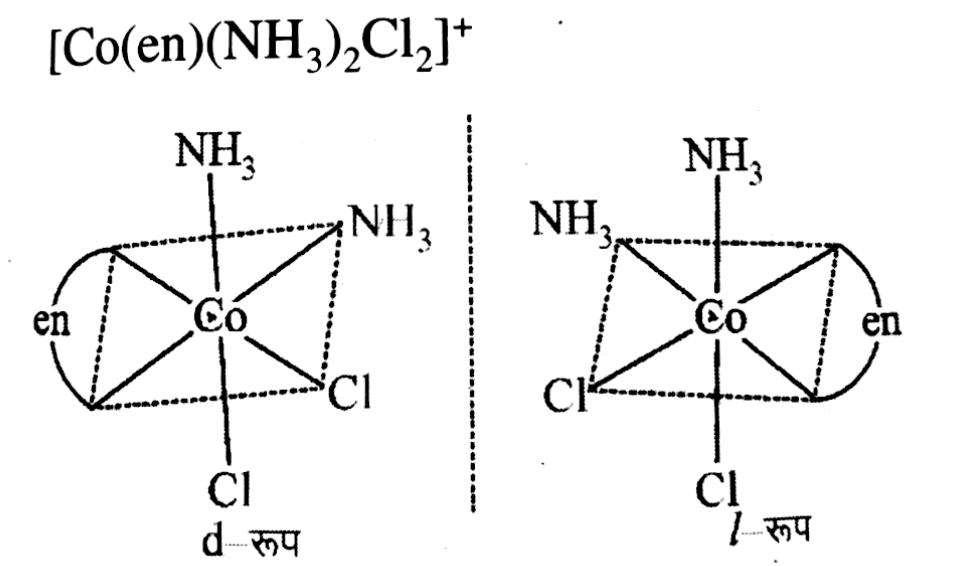
प्रकाशिक समावयावता
वे संकुल यौगिक जो समतल ध्रुवित प्रकाश के तल को बाये या दाये घुमाते हो उन्हें प्रकाशिक समावयवी कहते है | व इनके इस गुण को प्रकाशिक समावयावता कहते है |
वे समावयावी जो ध्रुवित प्रकाश के तल को दायी ओर घुमा देते है d या (+) तथा जो बायीं ओर घुमाते है l या (-) कहलाते है |